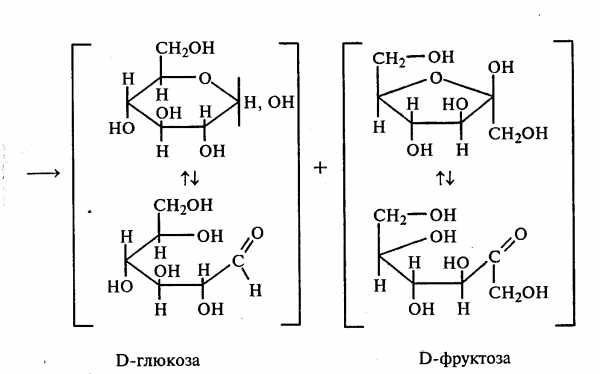
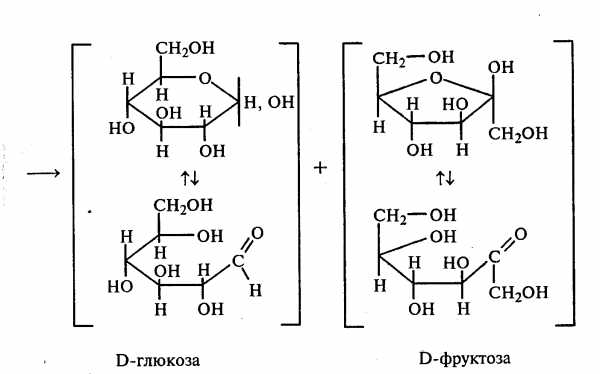
Опыт 15. Гидролиз (инверсия) сахарозы
Реактивы и оборудование:1%-ный раствор сахарозы, 10%-ный раствор серной кислоты, 10%-ный раствор гидроксида натрия, универсальная индикаторная бумага; пробирки.
В пробирку наливают 3 мл 1%-ного раствора сахарозы и 1 мл 10%-ного раствора серной кислоты. Для равномерного кипения в реакционную смесь добавляют фарфоровые кипятильники. Содержимое пробирки кипятят 3—5 мин, а затем охлаждают. При кипячении раствора сахарозы в кислой среде происходит ее гидролитическое расщепление:
|
|
Для доказательства гидролитического расщепления сахарозы необходимо провести реакции, подтверждающие наличие в содержимом пробирки продуктов гидролиза. Для этого содержимое пробирки делят на две части. Первую часть раствора нейтрализуют 10%-ным раствором гидроксида натрия (контроль по универсальной индикаторной бумаге), а затем добавляют равный объем реактива Фелинга и нагревают верхнюю часть жидкости. Наблюдают образование красного осадка оксида меди (I). Для сравнения нагревают смесь исходного раствора сахарозы с равным объемом реактива Фелинга. Окраска раствора не изменяется. Этот опыт показывает, что в результате гидролиза сахарозы, не способной восстанавливать реактив Фелинга, образуется смесь моносахаридов, окисляющихся фелинговой жидкостью.
2.3. Высшие полисахариды Опыт 16. Отношение полисахаридов к реактиву Фелинга
Реактивы и оборудование:1%-ный раствор крахмала, реактив Фелинга, пробирки.
В пробирку наливают 1 мл 1%-ного раствора крахмала. Затем добавляют равный объем реактива Фелинга. Жидкости тщательно перемешивают и нагревают верхнюю часть растворов до начинающегося кипения. Цвет растворов не изменяется.
Молекулы полисахаридов содержат в своем составе большое число соединенных друг с другом при помощи гликозидных связей остатков моносахаридов. Молекулы крахмала (амилоза и амилопектин) содержат в среднем от 1000 до 300000 остатков D-глюкозы. Однако в макромолекулах амилозы и амилопектина содержится всего по одному свободному гликозидному гидроксилу, который в растворе может дать альдегидную группу, поэтому концентрация альдегидных групп в растворе настолько мала, что крахмал не восстанавливает реактив Фелинга.
Опыт 17. Взаимодействие крахмала с йодом
Реактивы и оборудование:1%-ный раствор крахмала, сильно разбавленный раствор йода в иодиде калия; пробирки.
В пробирку наливают 1 мл 1%-ного раствора крахмала и добавляют в нее несколько капель сильно разбавленного раствора йода в иодиде калия. В пробирке с раствором крахмала развивается интенсивное синее окрашивание. При нагревании этого раствора до кипения синяя окраска исчезает, а при охлаждении появляется вновь.
Реакция крахмала с йодом представляет собой сложный процесс. Синюю окраску с йодом дает амилоза — одна из фракций крахмала. Амилоза — полисахарид линейного строения, состоящий из остатков α -D-глюкопиранозы. Ее молекулы имеют структуру спирали, внутри которой есть свободный канал диаметром около 5 мкм, в него внедряются молекулы йода, образуя окрашенные комплексы («соединения включения») за счет взаимодействия с гидроксильными группами моносахаридных остатков. При нагревании молекулы амилозы теряют свою спиралевидную структуру, и окрашенные комплексы разрушаются, при охлаждении спиралевидная структура амилозы и, следовательно, окрашенные комплексы восстанавливаются.
Для полисахаридов с разветвленными цепями (амилопектин и гликоген) наряду с процессами образования комплексов большое значение имеет процесс адсорбции йода на поверхности боковых цепей. Если боковые цепи в молекуле гликогена короткие, то развивается бурая окраска, если они длинные, то темно-красная.
studfiles.net
Опыты по химии. Углеводы | Подготовка к ЦТ и ЕГЭ по химии
Доказательство наличия гидроксильных групп в сахарозе
Докажем, что в состав молекулы сахарозы входят гидроксильные группы.
Прильем к раствору сахарозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае сахароза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт. Продукт реакции – сахарат меди (II).
Оборудование: штатив для пробирок, пробирки.
Техника безопасности. Соблюдать правила работы с растворами щелочей.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Качественная реакция глюкозы с аммиачным раствором оксида серебра (I)
Доказать наличие альдегидной группы в глюкозе можно с помощью аммиачного раствора оксида серебра. К аммиачному раствору оксида серебра добавим раствор глюкозы и подогреем смесь на водяной бане. Вскоре на стенках колбы начинает осаждаться металлическое серебро. Эта реакция называется реакцией серебряного зеркала. Ее используют как качественную для открытия альдегидов. Альдегидная группа глюкозы окисляется до карбоксильной группы. Глюкоза превращается в глюконовую кислоту.
СН2ОН – (СНОН)4 – СОН + Ag2O = СН2ОН – (СНОН) 4 – СООН + 2Ag↓
Реакцию серебряного зеркала используют в промышленности для серебрения зеркал, изготовления колб для термосов, елочных украшений.
Оборудование: колба круглодонная, горелка, стакан, штатив, прокладка огнезащитная.
Техника безопасности. Аммиачный раствор оксида серебра нельзя хранить. После опыта неиспользованный раствор нейтрализуют соляной кислотой.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Качественная реакция глюкозы с гидроксидом меди (II)
Глюкоза содержит в своем составе пять гидроксильных групп и одну альдегидную группу. Поэтому она относиться к альдегидоспиртам. Ее химические свойства похожи на свойства многоатомных спиртов и альдегидов. Реакция с гидроксидом меди (II) демонстрирует восстановительные свойства глюкозы. Прильем к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт. Нагреем раствор. Цвет раствора начинает изменяться. Сначала образуется желтый осадок Cu
СН2ОН – (СНОН)4 – СОН + Сu(ОН)2 = СН2ОН – (СНОН)4 – СООН + Сu2О↓+ Н2О
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок.
Техника безопасности. Соблюдать правила работы с растворами щелочей.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Кислотный гидролиз крахмала
В присутствии кислот крахмал гидролизуется. При гидролизе крахмала образуется глюкоза. Экспериментально проверим это. Прокипятим смесь крахмального клейстера и серной кислоты. Полноту гидролиза будем проверять с реакцией с йодом. Гидролиз проводится до тех пор, пока реакция с йодом не станет отрицательной, т. е. проба раствора не будет давать с йодом синего окрашивания. Проверим наличие глюкозы в полученном растворе. Прильем к раствору щелочь и несколько капель раствора сульфата меди (II). Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. Нагреем раствор. Выпадает красный осадок оксида меди (I).
(С6Н10О5)n + n
Мы доказали, что при гидролизе крахмала образовалась глюкоза.
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок, штатив, стакан, прокладка огнезащитная.
Техника безопасности. Соблюдать правила работы с растворами кислот.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Кислотный гидролиз сахарозы
В присутствии кислот дисахариды гидролизуются. При гидролизе сахарозы образуется глюкоза и фруктоза. Экспериментально проверим это. Прокипятим смесь растворов сахарозы и серной кислоты. Через несколько минут проверим наличие глюкозы в полученном растворе.
С12Н22О11 + Н2О = С 6Н12О6 + С6Н12О6
Прильем к раствору щелочь и несколько капель раствора сульфата меди (II). Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. Нагреем раствор. Выпадает красный осадок оксида меди (I). Мы доказали, что при гидролизе сахарозы образовалась глюкоза.
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок, штатив, стакан, прокладка огнезащитная.
Техника безопасности. Соблюдать правила работы с растворами кислот.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Кислотный гидролиз целлюлозы
При кислотном гидролизе целлюлозы образуется глюкоза. Проведем гидролиз в присутствии серной кислоты. В фарфоровой ступке разотрем вату с концентрированной серной кислотой. Полученную смесь разбавим водой и перенесем в стакан. Прокипятим смесь. Через несколько минут проверим наличие глюкозы в полученном растворе. Прильем к раствору щелочь и несколько капель раствора сульфата меди (II). Нагреем раствор. Выпадает красный осадок оксида меди (I). Мы доказали, что при гидролизе целлюлозы образовалась глюкоза. Кислотный гидролиз целлюлозы имеет важное промышленное значение. Брожением полученной глюкозы получают этиловый спирт.
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок, фарфоровая ступка с пестиком.
Техника безопасности. Соблюдать правила работы с концентрированными кислотами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Окисление глюкозы кислородом воздуха в присутствии метиленового голубого
Окисление глюкозы до глюконовой кислоты особенно легко протекает в щелочной среде в присутствии индикатора метиленового голубого. В колбе с водой растворим гидроксид натрия. Добавим туда глюкозу и затем немного раствора метиленового голубого. Через некоторое время раствор становится бесцветным. Перемешаем раствор. Он вновь окрашивается в голубой цвет.такие изменения окраски можно наблюдать много раз подряд. Под действием щелочи в водной среде глюкоза дегидрируется, превращаясь в глюконовую кислоту.
СН2ОН(СНОН)4СОН + Н2О = СН2ОН(СНОН)4СООН + 2Н
В отсутствии метиленового голубого отщепляющийся при дегидрировании водород окисляется кислородом воздуха очень медленно и реакция практически не идет. Метиленовый голубой присоединяет водород, превращаясь в бесцветное соединение. Это бесцветное соединение окисляется кислородом воздуха в метиленовый голубой, и вновь появляется голубая окраска. В процессе реакции индикатор практически не расходуется. Он является типичным катализатором окисления глюкозы до глюконовой кислоты.
Оборудование: шпатель, плоскодонная колба с пробкой.
Техника безопасности.
Соблюдать правила работы со щелочами и их растворами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Определение глюкозы в виноградном соке
Многие фрукты и ягоды содержат глюкозу. Определить наличие глюкозы можно с помощью гидроксида меди (II). Из ягоды винограда выжмем сок. Прильем к соку несколько капель раствора сульфата меди (II) и раствор щелочи. Нагреем раствор. Цвет раствора начинает изменяться. При кипячении раствора образуется желтый осадок Cu2O, который постепенно превращается в красный осадок CuO. Это доказывает наличие глюкозы в виноградном соке.
СН2ОН – (СНОН)4 – СОН + Сu(ОН)2 = СН2ОН – (СНОН)4 – СООН + Сu2О↓+ Н2О
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок.
Техника безопасности. Соблюдать правила работы с растворами щелочей.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Отсутствие восстанавливающей способности сахарозы
Экспериментально проверим отсутствие альдегидной группы у сахарозы. Приготовим сахарат меди (II). В пробирку с раствором сахарозы добавим раствор сульфата меди (II), воду и раствор щелочи. Образуется ярко синий сахарат меди (II). Раствор сахарата меди (II) нагреваем до кипения. Красного осадка оксида меди (I) не образуется. Следовательно, сахароза не имеет в своем составе свободную альдегидную группу и не обладает восстанавливающими свойствами.
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок.
Техника безопасности. Соблюдать правила работы с растворами щелочей.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Получение и свойства нитроцеллюлозы
Целлюлоза с азотной кислотой образует азотнокислые эфиры. Эфиры получают действием на целлюлозу смесью безводной азотной кислоты и концентрированной серной кислоты. Целлюлоза в нашем опыте — хлопковая вата.
Приготовим такую смесь и опустим в нее кусочек ваты. Через 15 минут процесс нитрования целлюлозы заканчивается. Промоем полученную нитроцеллюлозу водой. Высушим. Нитроцеллюлоза при поджигании быстро сгорает. Нитроцеллюлоза используется для приготовления бездымного пороха.
Оборудование: стакан, палочка, фильтровальная бумага, мерная пробирка.
Техника безопасности. Опыт необходимо проводить под тягой. Соблюдать правила работы с концентрированными кислотами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Растворение целлюлозы в аммиачном растворе гидроксида меди (II)
Целлюлоза нерастворима в воде и в большинстве растворителей. Однако в аммиачном растворе гидроксида меди (II) целлюлоза растворяется хорошо. Продемонстрируем это. В концентрированный аммиачный раствор опускаем небольшие порции ваты. Вата хорошо растворяется в данном растворе. Получается густой вязкий раствор целлюлозы в аммиачном растворе гидроксида меди (II). Раствор целлюлозы используют в промышленности для получения медноаммиачного шелка.
Оборудование: пробирка или стакан, стеклянная палочка.
Техника безопасности. Соблюдать правила работы с концентрированным раствором аммиака.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Реакция крахмала с иодом
Крахмал дает с иодом характерное синее окрашивание. С помощью иода можно открыть самые незначительные количества крахмала. К разбавленному раствору крахмала добавляем немного раствора иода (используем раствор Люголя: 1 часть иода, 2 части иодида калия, 17 частей дистиллированной воды). Появляется синее окрашивание. Нагреваем синий раствор. Окраска постепенно исчезает, так как образующееся соединение неустойчиво. При охлаждении раствора окраска вновь появляется. Данная реакция иллюстрирует обратимость химических процессов и их зависимость от температуры.
Оборудование: штатив для пробирок, пробирки.
Техника безопасности. Опыт безопасен.
Постановка опыта и текст – к.п.н. Павел Беспалов.
www.yoursystemeducation.com
Реакция Селиванова на кетозы
При нагревании с концентрированными минеральными кислотами, в данном случае с соляной кислотой, молекулы гексоз расщепляяются, образуя смесь различных продуктов. В числе других веществ они образуют 5-гидроксиметилфурфурол,
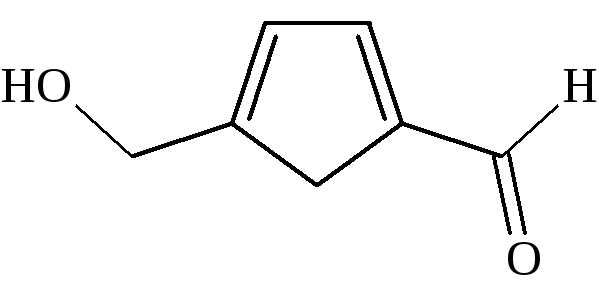
который конденсируется с резорцином, образуя окрашенные соединения. Эта реакция позволяет быстро обнаружить в смеси сахаров наличие кетогексоз.
При длительном кипячении и глюкоза может вызвать незначительное покраснение раствора. Альдозы, например, глюкоза, также могут образовать гидроксиметилфурфурол, но при этом вначале они переходят в кетозы.
Методика проведения: во вторую пробирку из опыта 2.5.3 помещают кристаллик резорцина и 2 капли соляной кислоты. Содержимое пробирки нагревают до начала кипения. Жидкость постепенно окрашивается в красный цвет.
Кислотный гидролиз сахарозы
С целью получения глюкозы и фруктозы проводят кислотный гидролиз сахарозы. Молекула сахарозы легко расщепляется при гидролизе на молекулу глюкозы и молекулу фруктозы. Оба моносахарида входят в состав сахарозы в циклических формах. В создании связи между ними участвуют оба гликозидных гидроксила.
В сахарозе остаток фруктозы находится в виде непрочного 5-членного цикла – фуранозы; такие сложные сахара очень легко гидролизуются.
Химизм процесса:
Методика проведения: в пробирку наливают две капли 1 %-ного водного раствора сахарозы, 2 капли 2 н соляной кислоты, 5 капель воды и осторожно нагревают над пламенем горелки 20–30 минут. Полученный раствор разливают на две пробирки, в которых открывают глюкозу и фруктозу.
Реакция крахмала с йодом
Методика проведения: в пробирку помещают 2 капли 2 %-ного крахмального клейстера и 1 каплю 0,1 н водного раствора йода. Содержимое пробирки окрашивается в синий цвет.
Полученную темно-синюю жидкость нагревают до кипения. Окраска при этом исчезает, но при охлаждении появляется вновь.
Крахмал является неоднородным соединением. Он представляет собой смесь двух полисахаридов – амилозы (20 %) и амилопектина (80 %). Амилоза растворима в теплой воде и дает с йодом синее окрашивание.
И амилоза, и амилопектин состоят из остатков глюкозы, связанных -гликозидными связями; но они отличаются формой молекул. Амилоза представляет собой линейный полисахарид, построенный из нескольких тысяч остатков глюкозы, обладающий структурой спирали. Внутри спирали остается свободный канал диаметром около 5 мк, в который могут внедряться молекулы, образуя особого типа комплексы – так называемые соединения включения (клатраты). Одним из них является соединение амилозы с йодом, имеющее синее окрашивание.
Строение амилозы схематически выражается следующей формулой:
Амилопектин в теплой воде нерастворим, набухает в ней, образуя крахмальный клейстер. В состав амилопектина, в отличие от амилозы, входят разветвленные цепи гликозных остатков.
Амилопектин с йодом дает красновато-фиолетовое окрашивание.
Амины
Обнаружение аминогруппы по реакции с 2,4-динитрохлорбензолом
В бесцветном 2,4-динитрохлорбензоле атом хлора весьма подвижен и в мягких условиях реагирует с аминами, образуя окрашенные в желтый цвет продукты конденсации:
Реакция происходит только со свободными основаниями.
Методика проведения: к 1–2 каплям исследуемого эфирного раствора вещества в пробирке прибавляют 1–2 капли 1 %-ного эфирного раствора 2,4-динитрохлорбензола, выпаривают эфир на водяной бане. Желтое или бурое остающееся пятно указывает на наличие аминов. Гетероциклы, содержащие атом азота с основными свойствами, также дают положительную реакцию (пиридин, хинолин, имидазол, пурин и т.д.).
studfiles.net
Крахмал с йодом. Реакция невидимости
Описание:
Одно из свойств крахмала – это способность давать синюю окраску при взаимодействии с йодом. Эту окраску легко наблюдать, если поместить каплю раствора йода на срез картофеля или ломтик белого хлеба. Крахмал в качестве резервного питания накапливается в клубнях, плодах, семенах растений. Так, в клубнях картофеля содержится до 24 % крахмала, в зёрнах пшеницы — до 64 %, риса — 75 %, кукурузы — 70 %.
С помощью йода можно открыть самые незначительные количества крахмала.
йод + крахмал => соединение темно-синего цвета
I2 + (C6H10O5)n => I2*(C6H10O5)n
(желт.) (прозр.) (синий)
К разбавленному раствору крахмала добавляем немного раствора йода. Появляется синее окрашивание. Нагреваем синий раствор. Окраска постепенно исчезает, так как образующееся соединение неустойчиво. При охлаждении раствора окраска вновь появляется. Данная реакция иллюстрирует обратимость химических процессов и их зависимость от температуры.
Если более подробно, то…
Крахмал представляет собой природный полимер. Причем крахмал не индивидуальное вещество, а смесь двух полимеров состава (С6Н10О5)n –амилозы (10–20 %) и амилопектина (80–90 %), состоящих из остатков a-D-глюкозы.
В целом крахмал – это белое твердое вещество без запаха и вкуса, малорастворимое в холодной воде.
Являясь многоатомным спиртом, крахмал образует простые и сложные эфиры. Характерной качественной реакцией на крахмал является его реакция с йодом.
При взаимодействии йода с крахмалом образуется соединение включения (клатрат). Клатрат – это комплексное соединение, в котором частицы одного вещества («молекулы-гости») внедряются в кристаллическую структуру «молекул-хозяев». В роли «молекул-хозяев» выступают молекулы амилозы, а «гостями» являются молекулы йода. Попадая в спираль, молекулы йода испытывают сильное влияние со стороны своего окружения (ОН-групп), в результате чего увеличивается длина связи до 0,306 нм (в молекуле йода длина связи 0,267 нм). Данный процесс сопровождается изменением бурой окраски йода на сине-фиолетовую (lмакс 620–680 нм).
Амилопектин, в отличие от амилозы, дает с йодом красно-фиолетовое окрашивание (lмакс 520–555 нм). Хотя содержание амилопектина в зернах крахмала в несколько раз превышает количество амилозы, тем не менее синее окрашивание, возникающее при действии йода на амилозу, перекрывает красно-фиолетовую окраску амилопектина. Окраска исчезает при нагревании и восстанавливается при охлаждении крахмального клейстера.
Крахмал широко распространен в растениях и является для них резервным источником энергии. В основном он содержится в клубнях, семенах и корнях в виде зерен.
Крахмал используют как пищевой продукт, компонент лекарственных средств и для накрахмаливания белья. Его применяют для получения патоки, глюкозы и этилового спирта, а также в аналитической химии для обнаружения йода.
virtuallab.by
Помогите пожалуйста с органической химией.
1)CuSO4 + 2NaOH =Cu(OH)2↓ + Na2SO4 2)При взаимодействии глюкозы с гидроксидом меди происходит окрашивание раствора в синий цвет — это качественная реакция для многоатомных спиртов. Количественные эксперименты показали, что в молекуле глюкозы 5 гидроксильных групп. Таким образом, глюкоза — это пятиатомный альдегидоспирт. 3)Раствор сахарозы растворяется в свежеприготовленном гидроксиде меди (II) с образованием сахарата меди (II) ярко-синего окрашивания. Для сахарозы характерна реакция многоатомного спирта.
1. CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4 2. HOCh3—(CHOH)4—CHO + Cu(OH)2 —> (t)HOCh3—(CHOH)4—COOH + Cu2O + 2h3O 3. Реакция с гидроксидом меди (II) является качественной реакцией на альдегидную группу, потому сахароза, не содержащая альдегидных групп (в отличие от глюкозы и фруктозы, из фрагментов которых состоит молекула сахарозы) , не реагирует с гидроксидом меди и не обладает восстановительными свойствами. 4. Качественная реакция на сахарозу: C12h32O11(сахароза) + h3O —> [H+](над стрелкой) C6h22O6(глюкоза) + C6h22O6(фруктоза) Сахароза не дает реакции «серебряного зеркала» и не обладает восстановительными свойствами. В этом ее отличие от глюкозы. Качественная реакция на глюкозу (обладает свойствами альдегидов) : а) реакция «серебряного зеркала». Ее используют как качественную для открытия альдегидов. Альдегидная группа глюкозы окисляется до карбоксильной группы. Глюкоза превращается в глюконовую кислоту. СН2ОН – (СНОН) 4 – СОН + Ag2O = СН2ОН – (СНОН) 4 – СООН + 2Ag↓ глюконовая кислота б) реакция с гидроксидом меди (II): HOCh3—(CHOH)4—CHO + Cu(OH)2 —>(t) HOCh3—(CHOH)4—COOH + Cu2O + 2h3O Качественная реакция на крахмал: с йодом возникает синее окрашивание.
)CuSO4 + 2NaOH =Cu(OH)2↓ + Na2SO4 2)При взаимодействии глюкозы с гидроксидом меди происходит окрашивание раствора в синий цвет — это качественная реакция для многоатомных спиртов. Количественные эксперименты показали, что в молекуле глюкозы 5 гидроксильных групп. Таким образом, глюкоза — это пятиатомный альдегидоспирт. 3)Раствор сахарозы растворяется в свежеприготовленном гидроксиде меди (II) с образованием сахарата меди (II) ярко-синего окрашивания. Для сахарозы характерна реакция многоатомного спирта
touch.otvet.mail.ru
Химические свойства сахарозы
В растворе сахарозы не происходит раскрытие циклов, поэтому она не обладает свойствами альдегидов.
1) Гидролиз (в кислотной среде):
C12H22O11 + H2O → C6H12O6 + C6H12O6.
сахароза глюкоза фруктоза
2) Являясь многоатомным спиртом, сахароза дает синее окрашивание раствора при реакции с Cu(OH)2.
3) Взаимодействие с гидроксидом кальция с образованием сахарата кальция.
4) Сахароза не реагирует с аммиачным раствором оксида серебра, поэтому ее называют невосстанавливающим дисахаридом.
Полисахариды.
Полисахариды– высокомолекулярные несахароподобные углеводы, содержащие от десяти до сотен тысяч остатков моносахаридов (обычно гексоз), связанных гликозидными связями.
Важнейшие из полисахаридов – это крахмал и целлюлоза (клетчатка). Они построены из остатков глюкозы. Общая формула этих полисахаридов (C6H10O5)n. В образовании молекул полисахаридов обычно принимает участие гликозидный (при С1 -атоме) и спиртовой (при С4 -атоме) гидроксилы, т.е. образуется (1–4) -гликозидная связь.
С точки зрения общих принципов строения полисахариды можно разделить на две группы, а именно: на гомополисахариды, состоящие из моносахаридных единиц только одного типа, и гетерополисахариды, для которых характерно наличие двух или более типов мономерных звеньев.
С точки зрения функционального назначения полисахариды также могут быть разделены на две группы: структурные и резервные полисахариды. Важными структурными полисахаридами являются целлюлоза и хитин(у растений и животных, а также у грибов, соответственно), а главные резервные полисахариды — гликоген и крахмал (у животных, а также у грибов, и растений соответственно). Здесь будут рассмотрены только гомополисахариды.
Целлюлоза (клетчатка) − наиболее широко распространенный структурный полисахарид растительного мира.
Главная составная часть растительной клетки, синтезируется в растениях (в древесине до 60% целлюлозы). Целлюлоза обладает большой механической прочностью и исполняет роль опорного материала растений. Древесина содержит 50-70% целлюлозы, хлопок представляет собой почти чистую целлюлозу.
Чистая целлюлоза – белое волокнистое вещество, без вкуса и запаха, нерастворимое в воде и в других растворителях.
Молекулы целлюлозы имеют линейное строение и большую молекулярную массу, состоят только из неразветвленных молекул в виде нитей, т.к. форма остатков β-глюкозы исключает спирализацию.. Целлюлоза состоит из нитевидных молекул, которые водородными связями гидроксильных групп внутри цепи, а также между соседними цепями собраны в пучки. Именно такая упаковка цепей обеспечивает высокую механическую прочность, волокнистость, нерастворимость в воде и химическую инертность, что делает целлюлозу идеальным материалом для построения клеточных стенок.
Целлюлоза состоит из остатков α,D-глюкопиранозы в их β-пиранозной форме, т. е. в молекуле целлюлозы β-глюкопиранозные мономерные единицы линейно соединены между собой β-1,4-глюкозидными связями:
При частичном гидролизе целлюлозы образуется дисахарид целлобиоза, а при полном гидролизе — D-глюкоза. Молекулярная масса целлюлозы 1 000 000−2 000 000. Клетчатка не переваривается ферментами желудочно-кишечного тракта, так как набор этих ферментов желудочно-кишечного тракта человека не содержит β-глюкозидазу. Вместе с тем известно, что присутствие оптимальных количеств клетчатки в пище способствует формированию кала. При полном исключении клетчатки из пищи нарушается формирование каловых масс.
Крахмал − полимер такого же состава, что и целлюлоза, но с элементарным звеном, представляющим собой остаток α-глюкозы:
Молекулы крахмала свернуты в спираль, большая часть молекул разветвлена. Молекулярная масса крахмала меньше молекулярной массы целлюлозы.
Крахмал – это аморфное вещество, белый порошок, состоящий из мелких зерен, не растворимый в холодной воде, но частично растворимое в горячей.
Крахмал представляет собой смесь двух гомополисахаридов: линейного — амилозы и разветвленного — амилопектина, общая формула которых (С6Н10O5)n.
При обработке крахмала теплой водой удается выделить две фракции: фракцию, растворимую в теплой воде и состоящую из полисахарида амилозы, и фракцию, лишь набухающую в теплой воде с образованием клейстера и состоящую из полисахарида амилопектина.
Амилоза имеет линейное строение, α, D- глюкопиранозные остатки связаны (1–4) -гликозидными связями. Элементная ячейка амилозы (и крахмала вообще) представляется следующим образом:
Молекула амилопектина построена подобным образом, однако имеет в цепи разветвления, что создает пространственную структуру. В точках разветвления остатки моносахаридов связаны (1–6) -гликозидными связями. Между точками разветвления располагаются обычно 20-25 глюкозных остатков.
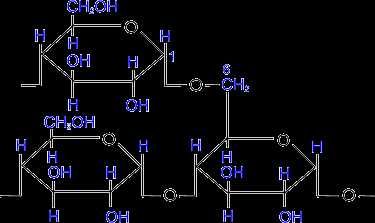 (амилопектин)
(амилопектин)
Как правило, содержание амилозы в крахмале составляет 10-30%, амилопектина — 70-90%. Полисахариды крахмала построены из остатков глюкозы, соединенных в амилозе и в линейных цепях амилопектина α-1,4-глюкозидными связями, а в точках ветвления амилопектина — межцепочечными α-1,6-глюкозидными связями.
В молекуле амилозы связано в среднем около 1000 остатков глюкозы, отдельные линейные участки молекулы амилопектина состоят из 20-30 таких единиц.
В воде амилоза не дает истинного раствора. Цепочка амилозы в воде образует гидратированные мицеллы. В растворе при добавлении йода амилоза окрашивается в синий цвет. Амилопектин также дает мицеллярные растворы, но форма мицелл несколько иная. Полисахарид амилопектин окрашивается йодом в красно-фиолетовый цвет.
Крахмал имеет молекулярную массу 106-107. При частичном кислотном гидролизе крахмала образуются полисахариды меньшей степени полимеризации — декстрины, при полном гидролизе — глюкоза. Крахмал является наиболее важным для человека пищевым углеводом. Крахмал образуется в растениях при фотосинтезе и откладывается в виде «резервного» углевода в корнях, клубнях и семенах. Например, зерна риса, пшеницы, ржы и других злаков содержат 60-80% крахмала, клубни картофеля – 15-20%. Родственную роль в животном мире выполняет полисахарид гликоген, «запасающийся», в основном, в печени.
Гликоген − главный резервный полисахарид высших животных и человека, построенный из остатков α-D-глюкозы. Эмпирическая формула гликогена, как и крахмала (С6Н10O5)n. Гликоген содержится практически во всех органах и тканях животных и человека; наибольшее количество его находится в печени и мышцах. Молекулярная масса гликогена 107-109 и выше. Его молекула построена из ветвящихся полиглюкозидных цепей, в которых остатки глюкозы соединены α-1,4-глюкозидными связями. В точках ветвления имеются α-1,6-глюкозидные связи. Гликоген по своему строению близок к амилопектину.
В молекуле гликогена различают внутренние ветви — участки полиглюкозидных цепей между точками ветвления, и наружные ветви — участки от периферической точки ветвления до нередуцирующего конца цепи. При гидролизе гликоген, подобно крахмалу, расщепляется с образованием сначала декстринов, затем мальтозы и, наконец, глюкозы.
Хитин − структурный полисахарид низших растений, в особенности грибов, а также беспозвоночных животных (главным образом членистоногих). Хитин состоит из остатков 2-ацетамидо-2-дезокси-D-глюкозы, связанных между собой β-1,4-глюкозидными связями.
Похожие статьи:
poznayka.org
Опыт 15. Гидролиз (инверсия) сахарозы
Реактивы и оборудование:1%-ный раствор сахарозы, 10%-ный раствор серной кислоты, 10%-ный раствор гидроксида натрия, универсальная индикаторная бумага; пробирки.
В пробирку наливают 3 мл 1%-ного раствора сахарозы и 1 мл 10%-ного раствора серной кислоты. Для равномерного кипения в реакционную смесь добавляют фарфоровые кипятильники. Содержимое пробирки кипятят 3—5 мин, а затем охлаждают. При кипячении раствора сахарозы в кислой среде происходит ее гидролитическое расщепление:
|
|
Для доказательства гидролитического расщепления сахарозы необходимо провести реакции, подтверждающие наличие в содержимом пробирки продуктов гидролиза. Для этого содержимое пробирки делят на две части. Первую часть раствора нейтрализуют 10%-ным раствором гидроксида натрия (контроль по универсальной индикаторной бумаге), а затем добавляют равный объем реактива Фелинга и нагревают верхнюю часть жидкости. Наблюдают образование красного осадка оксида меди (I). Для сравнения нагревают смесь исходного раствора сахарозы с равным объемом реактива Фелинга. Окраска раствора не изменяется. Этот опыт показывает, что в результате гидролиза сахарозы, не способной восстанавливать реактив Фелинга, образуется смесь моносахаридов, окисляющихся фелинговой жидкостью.
2.3. Высшие полисахариды Опыт 16. Отношение полисахаридов к реактиву Фелинга
Реактивы и оборудование:1%-ный раствор крахмала, реактив Фелинга, пробирки.
В пробирку наливают 1 мл 1%-ного раствора крахмала. Затем добавляют равный объем реактива Фелинга. Жидкости тщательно перемешивают и нагревают верхнюю часть растворов до начинающегося кипения. Цвет растворов не изменяется.
Молекулы полисахаридов содержат в своем составе большое число соединенных друг с другом при помощи гликозидных связей остатков моносахаридов. Молекулы крахмала (амилоза и амилопектин) содержат в среднем от 1000 до 300000 остатков D-глюкозы. Однако в макромолекулах амилозы и амилопектина содержится всего по одному свободному гликозидному гидроксилу, который в растворе может дать альдегидную группу, поэтому концентрация альдегидных групп в растворе настолько мала, что крахмал не восстанавливает реактив Фелинга.
Опыт 17. Взаимодействие крахмала с йодом
Реактивы и оборудование:1%-ный раствор крахмала, сильно разбавленный раствор йода в иодиде калия; пробирки.
В пробирку наливают 1 мл 1%-ного раствора крахмала и добавляют в нее несколько капель сильно разбавленного раствора йода в иодиде калия. В пробирке с раствором крахмала развивается интенсивное синее окрашивание. При нагревании этого раствора до кипения синяя окраска исчезает, а при охлаждении появляется вновь.
Реакция крахмала с йодом представляет собой сложный процесс. Синюю окраску с йодом дает амилоза — одна из фракций крахмала. Амилоза — полисахарид линейного строения, состоящий из остатков α -D-глюкопиранозы. Ее молекулы имеют структуру спирали, внутри которой есть свободный канал диаметром около 5 мкм, в него внедряются молекулы йода, образуя окрашенные комплексы («соединения включения») за счет взаимодействия с гидроксильными группами моносахаридных остатков. При нагревании молекулы амилозы теряют свою спиралевидную структуру, и окрашенные комплексы разрушаются, при охлаждении спиралевидная структура амилозы и, следовательно, окрашенные комплексы восстанавливаются.
Для полисахаридов с разветвленными цепями (амилопектин и гликоген) наряду с процессами образования комплексов большое значение имеет процесс адсорбции йода на поверхности боковых цепей. Если боковые цепи в молекуле гликогена короткие, то развивается бурая окраска, если они длинные, то темно-красная.
studfiles.net